
세계 3대 암학회로 불리는 AACR(미국암연구학회, American Association for Cancer Research)이 오는 4월 올랜도에서 개최됩니다. 바이오 업계에서는 이번 학회에서 항체약물접합체(ADC)와 키메릭항원수용체-T세포(CAR-T) 개발 기업들의 연구 결과를 주목해야 한다고 조언했습니다.
혈액암 CAR-T세포치료제를 개발하고 있는 앱클론(대표 이종서)이 대표적인 주목 대상 기업인데요. 앱클론은 이번 학회에서 CAR-T 치료제 후보물질 ‘AT101’에 대한 비임상 및 임상 1상 결과 일부를 발표할 예정으로 기술이전 논의가 구체화할 것으로 기대하고 있습니다.
회사 관계자는 “국내에서 임상 진행 중인 혈액암 치료제 AT101의 임상1상 용량 그룹 결과 발표가 있을 예정”이라며 “기술이전에 대한 논의를 진행 중으로 관련 회사와의 미팅도 예정돼 있다”고 말했습니다.
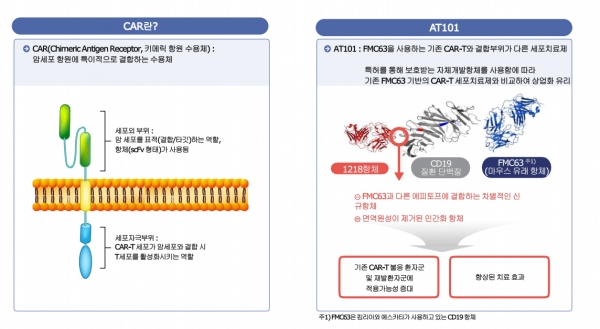
◆ 인간화항체 사용, 재발률 감소...“킴리아 등 기존 CAR-T불응 환자에 적용 가능”
앱클론이 개발하고 있는 혈액암 CAR-T세포치료제는 기존 마우스 유래 항체(FMC63)와 결합부위가 다른 세포치료제로 회사가 직접 개발한 신규 항체 h1218(인간화 항체)을 사용하고 있습니다.
회사 관계자에 따르면 "현재 전 세계에 상용화된 4종의 CD19(B림프구 항원) 표적 CAR-T 치료제는 모두 마우스 유래의 FMC63 항체를 공통으로 사용하고 있는 반면, 앱클론의 AT101은 독자적 기술로 개발한 h1218 인간화 항체를 사용해 CD19 질환 단백질의 새로운 부위에 작용하는 것이 특징"이라고 말했습니다.
따라서 기존의 치료제와는 다른 효과가 있을 것으로 기대하고 있으며 인간화 항체 사용에 따른 면역원성이 적어 CAR-T의 생체 내에서 지속성 증대로 재발률 또한 낮출 수 있을 것으로 보고 있습니다. 또한 기존 CAR-T와 다른 항체 사용으로 킴리아와 예쓰카타 등에 불응하는 환자들에게도 새롭게 적용이 가능해 치료의 기회가 더욱 확대될 것으로 예상하고 있습니다.
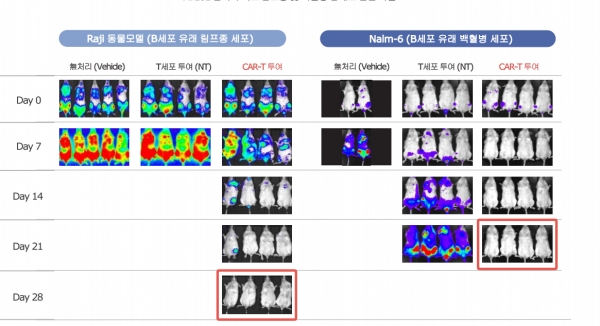
◆ AACR 2023서 '임상1상 중간결과 발표'..."'킴리아'대비 가격 경쟁력 및 효과 좋을 것"
회사는 지난 2월 혈액암 CAR-T 치료제 AT101에 대한 비임상 및 임상1상 결과 일부를 이번 AACR서 발표한다고 밝혔습니다.
최초의 CAR-T 치료제 킴리아를 개발하고 최근까지 CAR-T 연구를 선도하고 있는 펜실베니아 의과대학(UPENN) 림프종 사이언스 센터장 마르코 루엘라 교수가 연구팀을 대표해 직접 발표를 진행하며 기존 CAR-T 치료제들과의 차별점과 독자성 등을 소개할 예정입니다.
회사 관계자에 따르면 임상 1상 중간결과 발표의 핵심은 'AT101'의 투여 용량 그룹의 안전성과 치료효과입니다.
회사 관계자는 “저, 중, 고의 3개 용량 그룹 중 저, 중 용량 그룹까지의 결과를 발표할 예정이며 적응증은 4가지”라며 “DLBCL(diffuse large B cell lymphoma, 광범위B형대세포림프종), FL(follicular lymphoma, 소포림프종), MCL(mantle cell lymphoma, 외투세포림프종), MZL(marginal zone lymphoma, 변연부비세포림프종) 등의 다양한 혈액암에 적용해 ORR (객관적 반응률), CR (완전관해), 부작용 등의 내용을 다루게 될 것”이라고 말했습니다.
특히 회사 관계자는 "이번 임상1상에서 투여 용량에 따른 안정성 확보는 물론 '킴리아' 대비 ORR과 CR 등이 뛰어나 더욱 효과적이고 가격 경쟁력도 기대하고 있다"고 덧붙였습니다.
![▲앱클론 연구원 모습 [사진제공=앱클론]](/news/photo/202303/170889_146220_951.png)
◆ "자료 통한 글로벌 기술이전 가시화"...'9월 충분한 자금으로 임상2상 진행 예정'
회사는 이번 AACR에서 글로벌 미팅이 보다 활발할 것으로 예상하고 있습니다. 이는 임상 1상의 중간결과라는 '자료'를 통해 차기 임상 진행과 상업화에 더욱 속도가 붙었기 때문이라는 입장입니다.
회사 관계자는 “증명할 수 있는 자료가 생겼다”며 “보여줄 수 있는 자료를 바탕으로 글로벌 미팅 및 기술이전 논의가 더욱 활발할 것”이라고 밝혔습니다. 이어 "이미 기술이전을 논의 중인 여러 기업과 이번 학회에서 구체적인 미팅을 진행할 것"이라고 말했습니다.
이어 회사는 지난해 쿼드자산운용, 포커스자산운용, 신한캐피탈로부터 총 220억원의 전환우선주 및 전환사채가 발행돼 해당 자금을 통해 후속 임상을 차질없이 진행한다는 계획입니다.
회사 관계자는 “충분한 자금으로 오는 9월 임상2상을 진행할 계획”이라며 “임상 1상 중간결과에서 확인된 용량 결과에 따라 향후 투여 용량이 결정될 것”이라고 말했습니다. 그는 “적응증은 현재 DLBCL(diffuse large B cell lymphoma, 광범위B형대세포림프종)를 예상하고 있고, 80명 이상의 임상 환자를 대상으로 임상 2상을 진행할 계획”이라고 덧붙였습니다.
더불어 킴리아가 임상2상 결과로 조건부품목허가를 획득했듯이 'AT101'도 2025년 확보될 임상2상 결과를 통해 조건부 품목허가를 목표로 하고 있다고 밝히고 충분한 경쟁력을 자신한다고 강조했습니다.

