하나금융투자는 1일 제넥신에 대해 미국 임상종양학회(ASCO)에서 하이루킨7의 가치를 입증했다고 밝혔다. 또 제넥신에 대한 투자의견 ‘매수’, 목표주가 9만원을 유지했다.
지난 29일 제넥신은 ASCO에서 재발 전이성 삼중음성유방암 환자들을 대상으로 수행한 하이루킨 7과 키트루다와의 병용투여 임상 1b/2상(KEYNOTE-899) 중간결과를 발표했다.
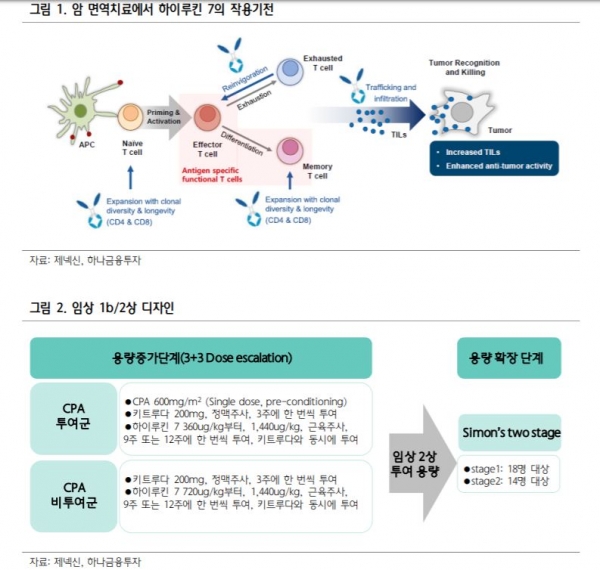
임상 1b상은 하이루킨 7과 키트루다 병용투여의 안전성과 내약성을 평가하고, 유효성을 입증하기 위한 임상 2상의 적정용량(RP2D)을 결정하기 위한 목적이다.
임상 2상은 객관적 반응률(ORR)을 평가하기 위해 수행됐으며 이번 임상에서 모집된 환자는 암이 전이된 상황에서 1차부터 3차까지의 표준 화학요법에 실패한 재발 삼중음성유방암 환자들이었다.
선민정 연구원은 “환자들은 포스파마이드(CPA)를 투여받으면서 하이루킨 7과 키트루다를 병용 투여받은 그룹과 CPA 투여 없이 하이루킨 7과 키트루다를 병용 투여받은 두 개의 그룹으로 진행됐다”고 말했다.
화학요법 치료제인 싸이클로 키트루다는 3주에 한 번씩 200mg 투여로 용량은 고정한 채, 하이루킨 7은 9주에 한 번 또는 12주에 한 번씩 360ug/kg부터 1440ug/kg까지 투여받으며 종양평가는 9주마다 측정됐다.
선 연구원은 “현재까지 관찰된 결과, 치료와 관련된 부작용(TEAEs)은 임상에 참여한 30명 전원에게서 나타났다”고 설명했다.
이어 “그러나 심각한 부작용이라 할 수 있는 grade 3는 23% 환자에게서 나타났고, grade 4 수준의 부작용을 보인 환자는 없었다”고 덧붙였다.
즉, 1200ug/kg 용량에서도 용량제한 독성반응(DLT)은 나타나지 않았다. 이러한 결과로 임상 1b상의 주요 목적 중 하나인 안전성과 내약성은 입증됐다.
그는 “하이루킨 7의 기능인 T 세포 증가가 모든 용량 투여군에서 나타났으며 하이루킨 7 투여용량이 증가할 수록 질병통제율(Disease control rate, DCR=PR+SD)이 높게 나타났다”고 밝혔다.
이어 “CPA 비투여군, 하이루킨 7 1,200ug/kg의 용량에서 50% ORR로 가장 양호한 결과가 도출됨에 따라 향후 임상 2상의 적정 투여용량은 하이루킨 7 1200ug/kg(CPA 비투여)으로 결정될 것”이라고 전망했다.
아울러 이 모든 결과는 4월 30일을 기준으로 평가된 것으로 추적관찰기간 중간값이 3.53개월(0.7~9.6개월)에 불과한 매우 짧은 기간이란 점에서 상당히 고무적이라고 평가했다.

